علم و فناوری عوامل اساسی در افزایش امید به زندگی هستند. در این راستا، رویکردهای خلاقانه و تجهیزات جدید ایجاد شده است که منجر به کاهش عوارض و مرگ و میر می شود. استفاده از روشهای دارورسانی برای افزایش اثربخشی مولکولهای فعال زیستی یک تکنیک ضروری برای درمان بیماریها است و توسعه در این زمینه قابل توجه بوده است. مواد زیستی یا بیومواد به طور کلی به سه دسته فلزات، سرامیک ها و پلیمرها دسته بندی می شوند. فلزات به طور گسترده برای ایمپلنت های تحمل بار استفاده می شود • سیم، پیچ، صفحات، مفصل مصنوعی برای لگن، زانو، شانه و غیره. بیومواد فلزی، مانند فولادهای زنگ نزن، آلیاژهای تیتانیوم، آلیاژهای کبالت، آلیاژهای نیکل، آلیاژهای منیزیم و … به دلیل ترکیبات عالی از خواص مکانیکی، به طور گسترده ای به عنوان دستگاه های قابل کاشت برای کاربردهای مختلف پزشکی استفاده می شوند.
پلیمرهای مصنوعی، نیمه مصنوعی و طبیعی معمولاً در توسعه سیستم های دارورسانی در این زمینه استفاده می شوند. بیوپلیمرها شامل پلیمرهای زیستی مبتنی بر پروتئین حیوانی مانند پشم، ابریشم، ژلاتین و کلاژن و پلی ساکاریدهایی مانند سلولز، نشاسته، پلیمرهای کربوهیدرات تولید شده توسط باکتری ها و قارچ ها می باشند.
بخیه زدن، تثبیت، چسبندگی، پوشاندن، انسداد، جداسازی، مهار تماس، تکثیر سلولی، هدایت بافت و تجویز کنترلشده دارو تنها برخی از کاربردهای دارویی است که بیوپلیمرها میتوانند برای آنها استفاده شوند. . چندین تکنیک و فرآیند تولید بیومواد در دهههای اخیر برای رسیدگی و بررسی ویژگیهای عملکردی مهم معماری و ترکیبی بافتهای طبیعی توسعه یافتهاند. شکار واحدهای کاشتنی بهتر و بافت محور، درک پتانسیل بیومواد را افزایش داده و علاقه به داربست های چندوجهی با اشکال منحصر به فرد و خواص فیزیکی-شیمیایی را افزایش داده است. این داربست ها به دلیل ادغام توپوگرافی های متنوعی که به طور کلی در هر ماده وجود ندارد، کیفیت های چند منظوره یا چندوجهی دارند، که ارتباط بالقوه آنها را در تکنیک های پزشکی احیا کننده افزایش می دهد. پلیمرها نقش مهمی در توسعه قالب های سه بعدی و ایجاد زیستگاه های ماتریکس خارج سلولی مصنوعی (ECM) برای بازسازی بافت دارند. بیوپلیمرها را می توان به صورت مصنوعی یا از دارایی های طبیعی سنتز کرد. طیف وسیعی از مواد کامپوزیت و شبکه های متقابل برای دستیابی به اهداف مورد نیاز استفاده شده است زیرا هر گروه دارای مزایا و محدودیت های خاصی است. با توجه به سازگاری پلیمرهای مصنوعی، که آنها را قادر می سازد تا با طیف گسترده ای از راندمان تخریب، ویژگی های ساختاری و ویژگی های مکانیکی تنظیم شوند، آنها منبع قابل اعتمادی از مواد نوآورانه هستند. ترکیب پلیمری مصنوعی ممکن است برای کاهش پاسخ ایمنی و ترکیب مهمترین ویژگیها طراحی شود. پلیمرهای طبیعی به دلیل زیست تخریب پذیری عالی و عدم سمیت سلولی، به عنوان جایگزین مناسبی برای مواد مصنوعی رایج پیشنهاد شده اند. آنها از منابع طبیعی مشتق شدهاند، شبیه بافتهای نرم هستند و از طریق فرآیندهای پلیمریزاسیون رشد زنجیرهای کاتالیز شده با آنزیم مونومرهای فعال، که اغلب در طی فعالیتهای متابولیکی در سلولها ایجاد میشوند، تشکیل میشوند. ژل های کلاژن، ژلاتین، دکستران، آگارز/آلژینات، اسید هیالورونیک، سلولز و فیبرین همگی در این دسته قرار می گیرند. علیرغم پاکسازی برای جلوگیری از واکنش جسم خارجی پس از کاشت، پلیمرهای طبیعی معمولاً در پزشکی احیا کننده استفاده می شوند. پلیمرهای زیست تخریب پذیر برای سیستم دارورسانی انتخاب شدند زیرا پس از آزاد شدن داروها برای برداشتن آنها نیازی به جراحی ندارند و ممکن است توسط بدن دفع شوند. برخی از نمونههای معروف کاربردهای زیستپزشکی که از بیوپلیمرها استفاده میکنند عبارتند از: پیوند عروقی جایگزین بافت نرم، ایمپلنتهای سینه، لنزهای داخل چشمی، قلبهای مصنوعی، اجزای اکسیژن سازهای خارج از بدن، لنزهای تماسی، واحدهای پلاسمافرزیس، بخیهها، چسبها و جایگزینهای خونی لوزالمعده، مثانه، کلیه، سیمان استخوان، کاتتر، ترمیم گوش خارجی و داخلی، پوششهای قرصها و کپسولهای دارویی، دستگاههای کمکی قلب، پمپهای قابل کاشت، ضربانساز، کپسولهها، دریچههای قلب، رگهای خونی مصنوعی، جایگزینهای پوست مصنوعی، دندانپزشکی، تحویل دارو و هدف قرار دادن مکان های تومور یا التهاب. از آنجایی که PHA ها زیست تخریب پذیر هستند، می توان از آنها به عنوان جایگزینی برای پلاستیک های پتروشیمی در کاربردهای زیست پزشکی استفاده کرد. سازگاری پلی (3-هیدروکسیوکتانوات) به ویژه آن را به عنوان یک پلیمر زیستی مناسب برای فرمولاسیون دارورسانی و همچنین ویژگی های مهندسی بافت آینده نگر تبدیل می کند.
بیوپلیمرها مواد آلی موجود در منابع طبیعی هستند. واژه پلیمر زیستی از کلمات یونانی بیو و پلیمر گرفته شده است که نشان دهنده طبیعت و موجودات زنده است. ماکرومولکولهای بزرگی که از واحدهای تکرار شونده متعددی تشکیل شدهاند به عنوان پلیمرهای زیستی شناخته میشوند. طبق تعریف IUPAC، یک ماکرومولکول یک مولکول واحد را تعریف می کند.
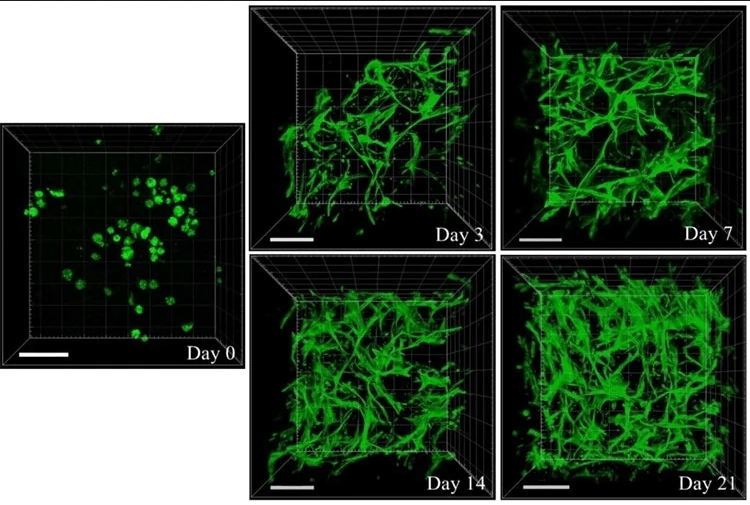
محققان NUS روشی را برای ساخت هیدروژل شبکه نفوذ بیولوژیکی (IPN) با استفاده از رئولوژی کاربردی کشف کردند. شکل موجود، محیط مساعد سلول شامل هیدروژل های صمغ کلاژن ژلان را نشان می دهد. سلولهای بنیادی مزانشیمی مشتق از چربی (ADSCs) در طی 21 روز ، رشد تدریجی مورفولوژی را به شکل دوک مانند معمول خود نشان می دهند. این شکل نشان می دهد که محیط مساعد سلول از هیدروژل های IPN چسبندگی، گسترش و تکثیر سلول را تسهیل می کند. F-actin (اسکلت سلولی) سلولها با معرف Phalloidin-iFluor 488 رنگ آمیزی شده است. تصاویر z-stack با میکروسکوپ اسکن لیزر کانفوکال (CLSM) و با استفاده از Zeiss LSM 710 به منظور تجزیه و تحلیل کامل هیدروژل های مملو از سلول ثبت شد. چسبندگی سلول و گسترش سلول در داخل هیدروژلهای IPN در هر 3 بعد قابل مشاهده است (نوار مقیاس: 100 میکرومتر).
اعتبار تصویر: ACS Applied Bio Materials
هیدروژل ها شبکه های سه بعدی از پلیمرهای لینک شده هستند. با این حال ، پانسمان های زخم هیدروژلی فعلی از پلیمرهای مصنوعی ساخته شده اند که از نظر بیولوژیکی بی اثر هستند و زیست شناسی بدن میزبان را به سمت ترمیم زخم سوق نمی دهند. چنین روش درمانی به ویژه برای زخم های شدید که برای بازسازی واسطه های برون زا بسیار مهم هستند متناقض است. اخیراً ، پیشنهاد شده است که سلولهای بنیادی در هیدروژلها گنجانده شوند تا پانسمانهای بی اثر با خواص بیولوژیکی ایجاد کنند. سلول ها توانایی آزادسازی فاکتورهای بهبود زخم پاراکرین و تفکیک به سلول های پوستی متعدد را برای جایگزینی بافت های از دست رفته دارند. به منظور تکرار جنبه های ماتریکس خارج سلولی بومی سلول های بنیادی (ECM) ، محققان به پلیمرهای طبیعی روی آورده اند که از نظر سازگاری با سلول ها سازگارتر هستند.
صمغ ژلان که یک اگزوپلی ساکارید ترشح شده با باکتری Sphingomonas elodea از منبع طبیعی است ، از نظر FDA GRAS و تولید با بازده بالا به رسمیت شناخته می شود. صمغ ژلان اگرچه در شرایط فیزیولوژیکی به راحتی تشکیل هیدروژل می دهد ، اما برای جایگیری موثر سلول های بنیادی فاقد قسمت چسبندگی سلولی است. این مشکل می تواند با استفاده از یک شبکه پلیمر کلاژن ثانویه برای ایجاد هیدروژل های صمغ ژلان با چسبندگی سلول برطرف شود.
با این حال ، صمغ ژلان و کلاژن سازوکارهای ژل زایی وابسته به دما را دارند و باعث می شود مرحله ترکیب محلول آنها دشوار باشد. با استفاده از رئولوژی کاربردی ، یک تیم تحقیقاتی به سرپرستی پروفسور Rachel EE از گروه داروسازی، دانشگاه ملی سنگاپور از روشی برای کنترل دقیق دما برای یک هیدروژل IPN بین صمغ ژلان و کلاژن رونمایی کرد تا این ماده به صورت طبیعی تشکیل شود. رویکرد تیم او برای تبدیل صمغ ژلان به داربست بیولوژیک با کلاژن، پیشرفت قابل توجهی داشت که به طور بالقوه ممکن است به توسعه تجاری منجر شود. سلول های بنیادی محصور شده با استفاده از هیدروژل IPN قادر به چسبیدن و تکثیر در ماتریس ژل بودند. آزمایشات بیشتر مدل حیوانی ثابت کرد که هیدروژل های پر سلول IPN قادر به بهبود زخم در آسیب های شدید سوختگی هستند.
پروفسور Ee گفت ، “ما به همراه شرکای خود در Roquette ، متعهد به استخراج منابه متنوع غنی از مواد گیاهی برای مصارف زیست پزشکی هستیم. کار ما یک نمونه هیجان انگیز از چگونگی وابستگی آکادمی و صنعت است که می تواند منابع ما را برای اکتشافات تأثیرگذار یک جا جمع کند. “
منابع:
https://www.science.nus.edu.sg/
https://www.azom.com/news.aspx?newsID=56095



